物質の三態の覚え方
固体→液体→気体
この駅で誘拐状とは古希でしょうか?
気体→液体→固体
消えた子、しゅく子と聞こう商業歌
蒸気圧降下と沸点上昇
徐行で浮上、よし、喉にヒレ
物質の三態
物質の三態については、それぞれの言葉の意味について出題されます。
当たり前すぎる知識ですが、勘違いのないように整理して覚えなおしておきましょう。
- 固体
- 液体
- 気体
物質の三態の変化
融解、蒸発、凝固、凝縮
現象 融解 蒸発
温度 融点 沸点
熱を吸収 (融解熱) (蒸発熱・気化熱)
→ →
固体 液体 気体
← ←
熱を放出 (凝固熱) (凝縮熱)
現象 凝固 凝縮(液化)
温度 凝固点 沸点
昇華
昇華は、固体が液体になることなしに直接気体になることです。
昇華する物質には硫黄やナフタレンがあります。
現象 昇華
熱を吸収 昇華熱
→
固体 気体
←
熱を放出 昇華熱
現象 昇華(凝華)
物質の三態の変化のまとめ
固体→液体→気体
固体<→融解→>液体<→蒸発→>気体
固体<→昇華→>気体
語呂:この駅で誘拐状とは古希でしょうか?
(融解を文書で伝えようとしているから高齢者だと推理しています)
この :固体
え :液体
きで :気体
誘拐 :融解
状とは :蒸発
古 :固体
希で :気体
しょうか:昇華
気体→液体→固体
固体<←凝固←>液体<←凝縮←>気体
固体<←昇華(凝華)←>気体
語呂:消えた子、しゅく子と聞こう商業歌
消 :気体
えた :液体
子 :固体
しゅく:凝縮
子と :凝固
聞 :気体
こう :固体
商 :昇華
業歌 :凝華
三態の変化と温度
- 融解:融点
- 蒸発:沸点
- 凝固:凝固点
- 凝縮:凝縮点
水の場合、融点と凝固点、沸点と凝縮点は一致
→これらが異なる物質もある(高分子化合物等)
融解熱と蒸発熱
- 融解熱:固体1gが融解するときに吸収される熱量
- 蒸発熱(気化熱):液体1gが蒸発するときに吸収される熱量
物質の状態図
物質の状態図は、ある温度と圧力における物質の状態(三態)を示した図です。
下の図は水の状態図です。
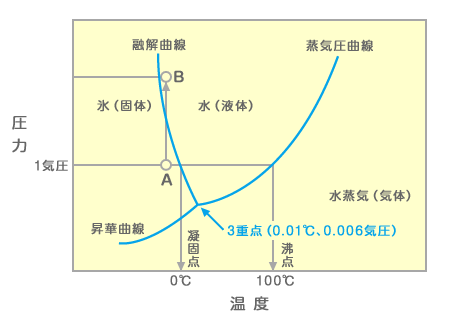
- 融解曲線:固体と液体の境界線、固体と液体が共存
- 蒸気圧曲線:液体と気体の境界線、液体と気体が共存
- 昇華圧曲線:固体と気体の境界線、固体と気体が共存
- 三重点:3本の曲線の交点、三態が共存
- 臨界点:気体と液体の区別がつかなくなる圧力と温度→圧力を高めても凝縮が起こらなくなる
沸点と飽和蒸気圧
沸点と沸騰
沸点は、液体が沸騰をはじめる温度です。
沸騰は、液体内部から起こる気泡の形成を伴う気化現象です。
液体内部で気泡がつくられることがポイントです。
飽和蒸気圧
気液平衡になったときの気体の圧力が、その温度における飽和蒸気圧です。
気液平衡
気液平衡は、液体から気体になる蒸発と、気体から液体になる凝縮の速度が等しくなり、液体と気体の量が変化しなくなっているように見える状態です。
言い換えると、見かけ上、液体と気体の変化が起こっていない状態のことです。
一般に、液体の温度が上昇すると、飽和蒸気圧は上昇します。
温度上昇とともに飽和蒸気圧も増大、沸点になると飽和蒸気圧が外気圧と等しくなり、蒸発速度が凝縮速度を上回るようになります。
外気圧 外気圧
↓↓↓↓↓↓↓ ↓↓↓↓↓↓↓
―――――――――――液面 ⇒ ―――――――――――液面
↑ ↑ ↑ ↑ 液温上昇 ↑↑↑↑↑↑↑
飽和蒸気圧 飽和蒸気圧
これが沸騰で、液体が沸騰しているとき、その飽和蒸気圧は外気圧と等しくなっています。
蒸気圧降下
蒸気圧降下
蒸気圧降下は、不揮発性物質を溶かした(希薄)溶液の蒸気圧が、純溶媒に比べ低くなることです。
例えば、砂糖や塩を水に溶かすと、蒸気圧が水よりも下がるということです。
蒸気圧降下と沸点上昇
不揮発性物質を溶かした(希薄)溶液の沸点は純溶媒に比べ高くなります。
つまり、蒸気圧降下があると、沸点は上昇します。
例えば、砂糖や塩を水に溶かすと、沸点が上がり、100℃以上になるということです。
溶液の蒸気圧が低下
→外気圧と飽和蒸気圧が等しくなるためにはより高い温度が必要
→より高い温度で沸騰
=沸点上昇
蒸気圧降下と溶質の濃度
希薄溶液の蒸気圧降下の程度は、溶質の種類に関係なく、溶質の濃度(質量モル濃度)に比例します。
語呂:徐行で浮上、よし、喉にヒレ
(半魚人か何かが、ゆっくり浮上しながら喉のヒレを確認しています)
徐行で :蒸気圧降下
浮上 :沸点上昇
よし :溶質の
喉に :濃度に
ヒレ :比例
甲種試験では、溶質の濃度を比較させる問題も出ますが、乙種試験では、蒸気圧降下と沸点上昇は、溶質の質量モル濃度に比例することだけ覚えていれば十分です。



